近日,北京大学第三医院超声医学科王淑敏教授、梁晓龙研究员团队在Advanced Science(《先进科学》)上发表了题为“Ultrasound Controlled-Release Hydrogel Promotes Diabetic Wound Healing via Neuroimmune Modulation and Synergistic ROS Scavenging”(超声控释水凝胶通过神经-免疫调控协同活性氧清除促进糖尿病创面愈合)的研究论文。该研究构建了一种超声响应型水凝胶递送系统MCF@CA,为糖尿病创面治疗提供了新策略。

论文截图
糖尿病创面愈合迟缓,涉及炎症持续、氧化损伤、神经功能减退和血管新生困难等多种复杂问题相互影响,形成愈合难的恶性循环。以往治疗多直接针对创面局部的异常状态,而忽略了感觉神经作为指挥免疫修复“上游开关”的关键角色。神经末梢分泌的降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)是促进创面从发炎转向修复的关键信号分子。然而,糖尿病神经病变及创面有害的活性氧物质,共同阻断了这一重要的神经-免疫通讯。
此外,常规药物涂抹或敷料难以精确控制释放,CGRP等活性成分在创面复杂环境中极易快速失效,无法实现稳定、长期的促愈合作用,疗效因此受限。
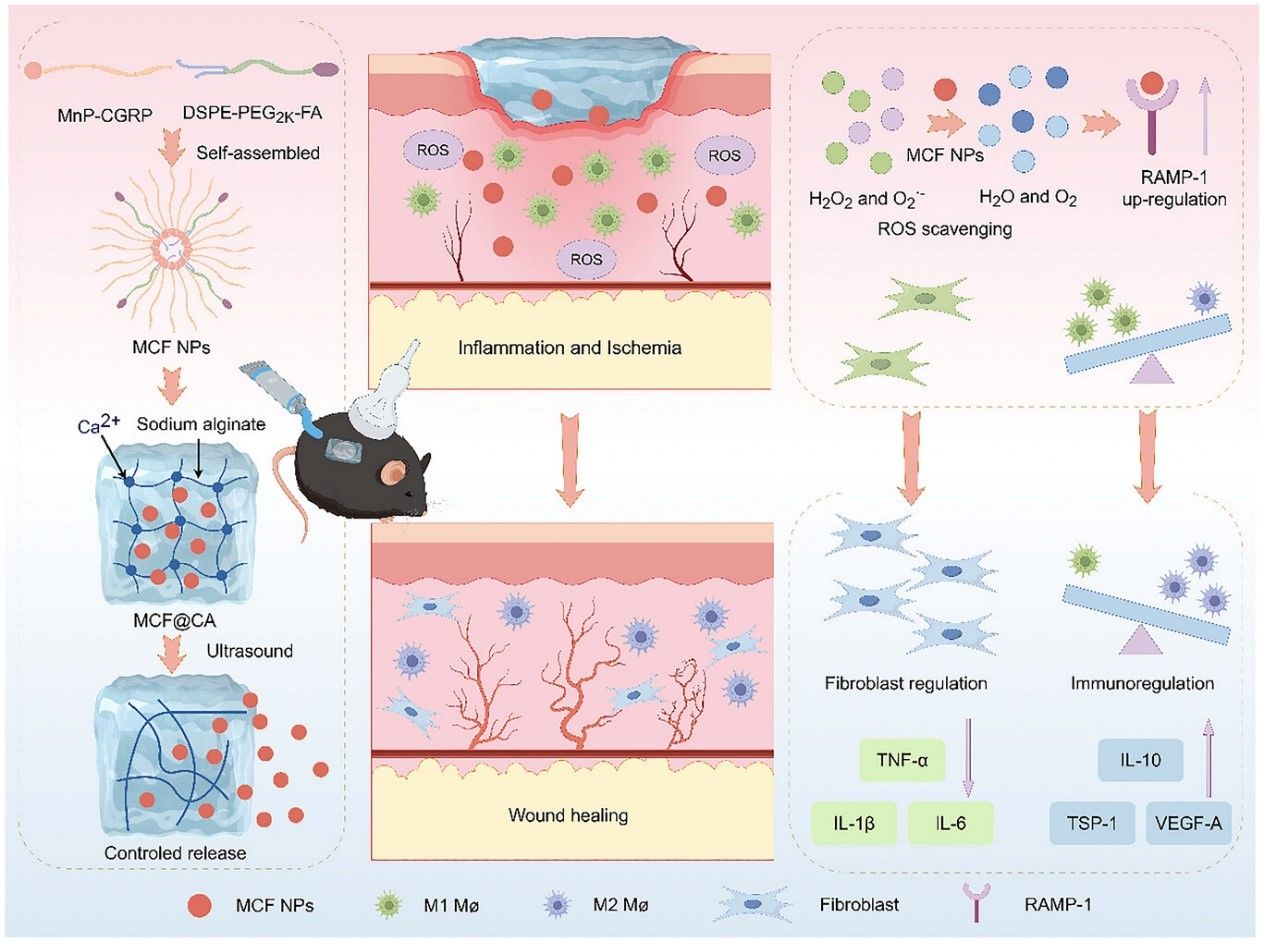
神经-免疫调控协同活性氧清除的超声控释水凝胶系统治疗糖尿病创面的作用机制图
针对上述挑战,团队设计并构建了名为MCF@CA的超声控释水凝胶平台,其核心创新点在于:
一、“双效合一”的药物体系。通过巧妙设计,将负责神经免疫调节的CGRP与能够清除有害活性氧的锰卟啉共价连接在一起,形成一个同时具备两种治疗功能的复合分子,从源头实现协同增效。
二、“精准高效”的靶向递送。该复合分子进一步组装成纳米颗粒,并装备了能够精准识别创面炎症细胞的叶酸,有效提高药物在创面的滞留时间和递送效率。
三、“按需给药”的超声控释。将靶向纳米颗粒装载于海藻酸钠水凝胶中。该水凝胶在超声作用下,其交联结构降解,从而实现内部药物的按需、精准释放。医生可根据临床需求,通过调节超声参数个性化控制给药速度与剂量,极大提升了治疗的灵活性与适应性。
四、“开放兼容”的通用平台。该水凝胶系统作为一个基础载体,未来可兼容并装载不同的治疗药物,为开发系列产品奠定了基础,平台拓展性强。同时,该水凝胶还兼具可注射特性,可适应不同部位的治疗场景。
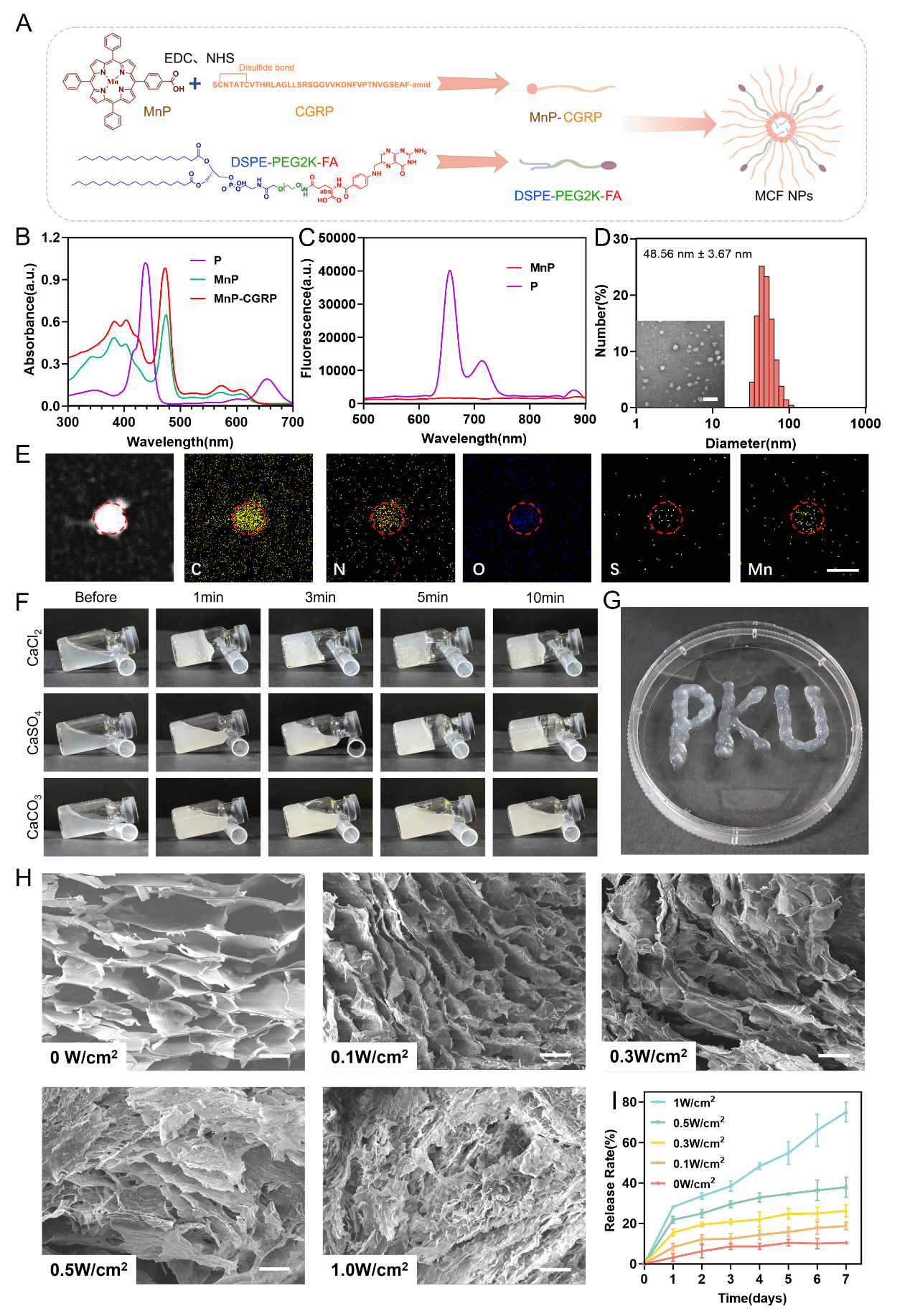
MCF@CA的制备及其可注射性、超声控释能力验证
该研究构建的MCF@CA系统具有良好的生物相容性,其超声控制释放的特性为临床适应复杂多变的创面状况提供了极大灵活性。这种将神经调节与抗氧化及促修复功能整合于一体并实现超声控制释放的策略,为糖尿病慢性创面及其他应用场景提供了全新的思路和有巨大转化潜力的平台。
北京大学第三医院超声医学科李莫凡和王梦欣博士为本文共同第一作者,王淑敏教授和梁晓龙研究员为共同通讯作者。该研究得到了国家自然科学基金、北京市自然科学基金及北京大学第三医院临床重点项目等项目的资助。

3月20日是世界口腔健康日,它是由FDI(世界牙科联盟)发起的全球规模最大的口
岁岁重阳,今又重阳。历经大疫后的国人对于健康和尊老敬老似乎又多了一番新
阳春三月,春光明媚。虽然疫情的阴霾还未完全消散,但此时已莺飞草长,鸟语花
岁岁重阳,今又重阳。历经大疫后的国人对于健康和尊老敬老似乎又多了一番新
阳春三月,春光明媚。虽然疫情的阴霾还未完全消散,但此时已莺飞草长,鸟语花